
- Autor Stanley Ellington ellington@answers-business.com.
- Public 2023-12-16 00:15.
- Última modificación 2025-01-22 15:57.
Los ácidos carboxílicos tienen altos puntos de ebullición en comparación con otras sustancias de masa molar comparable. Puntos de ebullición aumenta con la masa molar. Los ácidos carboxílicos que tienen de uno a cuatro átomos de carbono son completamente miscibles con agua. La solubilidad disminuye con la masa molar.
También la pregunta es, ¿cuáles son las propiedades químicas del ácido carboxílico?
Propiedades de los ácidos carboxílicos . Ácidos carboxílicos son solubles en agua. Ácidos carboxílicos no se dimeriza en agua, pero forma enlaces de hidrógeno con el agua. Ácidos carboxílicos son polares y debido a la presencia del hidroxilo en el carboxilo grupo, son capaces de formar enlaces de hidrógeno con moléculas de agua.
Posteriormente, la pregunta es, ¿cuáles son las propiedades del grupo carboxilo? Propiedades del grupo carboxilo Grupo carboxilo se compone de un doble enlace de oxígeno electronegativo a un átomo de carbono. Como resultado, habrá un aumento en la polaridad de un enlace. Un compuesto que comprende un grupo carboxilo poseerá un alto punto de fusión, centros hidrófilos y punto de ebullición.
También sepa, ¿cuál es la propiedad química más importante de los ácidos carboxílicos?
El jefe químico característica de la ácidos carboxílicos es su acidez. Por lo general, son más ácidos que otros compuestos orgánicos que contienen grupos hidroxilo, pero generalmente son más débiles que el mineral familiar. ácidos (p. ej., clorhídrico ácido , HCl, sulfúrico ácido , H2ASI QUE4, etc.).
¿Cuáles son las propiedades químicas de los ésteres?
Ésteres , como los aldehídos y las cetonas, son moléculas polares y, por lo tanto, tienen interacciones dipolo-dipolo, así como fuerzas de dispersión de van der Waals. Sin embargo, no forman enlaces de hidrógeno éster-éster, por lo que sus puntos de ebullición son significativamente más bajos que los de un ácido con el mismo número de átomos de carbono.
Recomendado:
¿Cuál es el derivado del ácido carboxílico más reactivo?
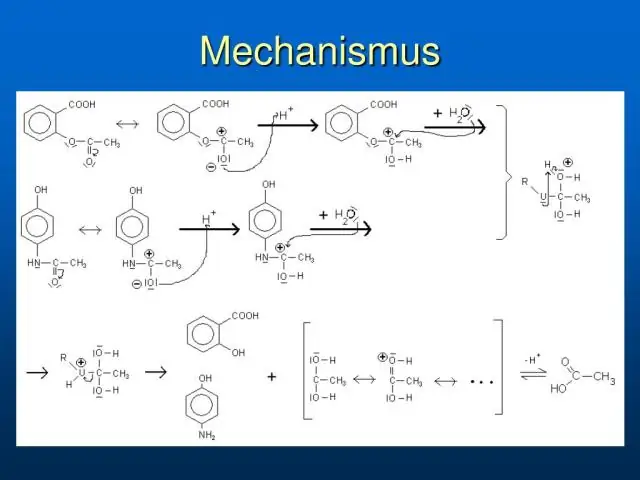
Los diferentes derivados del ácido carboxílico tienen reactividades muy diferentes, siendo los cloruros y bromuros de acilo los más reactivos y las amidas las menos reactivas, como se indica en la siguiente lista ordenada cualitativamente. El cambio de reactividad es dramático
¿Cuáles son las propiedades del eteno?

El eteno es un gas incoloro con un olor dulzón muy ligero. Tiene punto de fusión -169oC. Tiene punto de ebullición -104oC. Es insoluble en agua pero soluble en alcohol y éter
¿Qué sucede con los valores de las propiedades cuando suben las tasas de interés?

Las tasas de interés pueden afectar significativamente el costo de financiamiento y las tasas hipotecarias, lo que a su vez afecta los costos a nivel de propiedad y, por lo tanto, influye en los valores. A medida que disminuyen los tipos de cambio interbancarios, se reduce el costo de los fondos y los fondos fluyen hacia el sistema; por el contrario, cuando las tasas suben, la disponibilidad de fondos disminuye
¿Cuál es el uso del ácido carboxílico?
Los derivados del ácido carboxílico tienen diversas aplicaciones. Por ejemplo, además de su uso como desinfectante, el ácido fórmico, el ácido carboxílico más simple, se emplea en el tratamiento de textiles y como agente reductor de ácido. El ácido acético se utiliza ampliamente en la producción de ésteres y plásticos de celulosa
¿Cuál es la diferencia entre un aldehído, una cetona y un ácido carboxílico?

Los aldehídos y cetonas contienen el grupo funcional carbonilo. En un aldehído, el carbonilo está al final de una cadena de carbono, mientras que en una cetona, está en el medio. Un ácido carboxílico contiene el grupo funcional carboxilo
